~ Los enlaces iónicos se forman entre cationes y aniones...
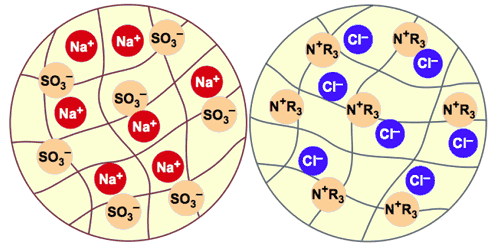
Una partícula con una o más unidades de carga eléctrica se denomina ion. Cuando un átomo acepta o dona uno o más electrones, se convierte en un ion. Los iones con carga positiva se denominan cationes, mientras que los aniones poseen carga negativa. Los grupos de átomos pueden donar o aceptar protones además de electrones. por lo tanto, pueden convertirse en un catión si pierden uno o más electrones o también si ganan uno o más protones. Por otro lado, un grupo de átomos se convierte en un anión si gana uno o más electrones o pierde uno o más protones.
Un enlace iónico se forma como consecuencia de la atracción entre la carga positiva de un catión y la carga negativa de un anión. Un compuesto iónico es una sustancia que consiste en aniones y cationes, que se mantienen unidos en virtud de sus cargas opuestas.
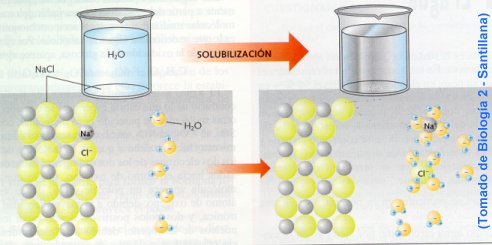
Los compuestos unidos por enlaces iónicos, tienden a disociarse (separarse) en sus iones componentes cuando son colocados en agua. El agua es un extraordinario solvente, un líquido que puede disolver muchas sustancias.
Una sustancia disuelta se denomina soluto. En la solución, cada catión y cada anión del compuesto iónico quedan rodeados por los extremos con carga opuesta de las moléculas de agua, proceso que se denomina hidratación.
~ Los enlaces de hidrógeno son atracciones débiles...
Los enlaces de hidrógeno tienden a formarse entre un átomo con carga negativa parcial y uno de hidrógeno unido en forma covalente a oxígeno o a nitrógeno.
Los enlaces de hidrógeno se forman y rompen fácilmente.
~ Los electrones y su energía se transfieren en reacciones redox...
La transferencia de un electrón conlleva la transferencia de la energía de ese electrón. Este proceso en una reacción de oxidación - reducción o reacción redox.
La oxidación es un proceso químico en que un átomo, ion o molécula cede electrones.
La reducción es un proceso químico en que un átomo, ion o molécula recibe electrones.
En una reacción redox un componente, el agente oxidante, acepta uno o más electrones y se reduce. El agente reductor cede uno o más electrones y se oxida en el proceso.
Los electrones no se separan con facilidad de los compuestos covalentes, a menos de que se extraiga todo el átomo.
~ Las moléculas de agua son polares...
Las moléculas de agua son polares; es decir, un extremo de cada molécula posee carga positiva parcial, y el otro tiene carga negativa parcial.
El átomo de oxigeno de una molécula de agua tiene dos regiones de carga negativa parcial, y cada uno de los dos hidrógenos tiene una carga positiva parcial.
~ El agua es el principal solvente en los organismos...
Las sustancias que interactúan fácilmente con el agua son hidrófilas ( "afines al agua" ), mientras que las sustancias que no se disuelven en agua se denominan hidrófobas ( "que repelen el agua" ).
~ La formación de enlaces de hidrógeno hace al agua cohesiva y adhesiva...
Las moléculas e agua tiene una fuerte tendencia a adherirse entre si; esto es, son cohesivas.
Las moléculas de agua también se adhieren a muchos otros tipos de sustancias, muy notablemente las que tienen grupos de átomos o moléculas con carga eléctrica en su superficie. Estas fuerzas adhesivas explican el que el agua humedezca las cosas.
Una combinación de fuerzas adhesivas y cohesivas explica la tendencia del agua, denominada capilaridad, a avanzar en tubos estrechos, aún contra la fuerza de la gravedad.
El agua tiene un alto grado de tensión superficial debido a la cohesividad de sus moléculas.
~ El agua ayuda a conservar estable la temperatura...
Para elevar la temperatura de una sustancia es necesario agregar energía calorífica a fin de hacer que sus moléculas se muevan más rápido; esto es, incrementar la energía cinética de las moléculas. El término calor se refiere a la cantidad total de energía cinética en una muestra de una sustancia; la temperatura se refiere a la cantidad promedio de energía cinética de las partículas.
Una caloría es una unidad de energía térmica (4.184 J) y corresponde a la cantidad de calor necesario para aumentar un grado Celsius (1ºC) la temperatura de 1 g. de agua.
~ Los ácidos son donadores de protones; las bases son aceptoras de protones...
Las moléculas de agua tiene una tendencia leve a ionizarse, o sea a disociarse en iones de hidrógeno e hidróxido.
Un ácido es una sustancia que se disocia en solución de manera que se generan hidrogeniones (H⁺) y un anión. Un ácido es un donador de protones. Las soluciones ácidas tiene mayor concentración de hidrogeniones que de iones hidróxido. Cambian a rojo el papel tornasol azul y tienen sabor agrio.
Una base se define como un aceptor de protones. Son sustancias que se disocian en un ion hidróxido (OH⁻) y un catión al disolverlas en agua. Una solución básica es aquella en la cual la concentración de hidrogeniones es menor que la de iones hidróxido. Cambian a azul el papel tornasol rojo y son resbaladizas al tacto.
~ El pH es una medida conveniente de acidez...
El grado de acidez de una solución suele expresarse en términos de pH, que se define como el logaritmo negativo (base 10) de la concentración de hidrogeniones.
Las soluciones ácidas tienen valores de pH menores de 7, y las soluciones básicas tienen pH mayor a 7.
~ Los amortiguadores minimizan los cambios de pH...
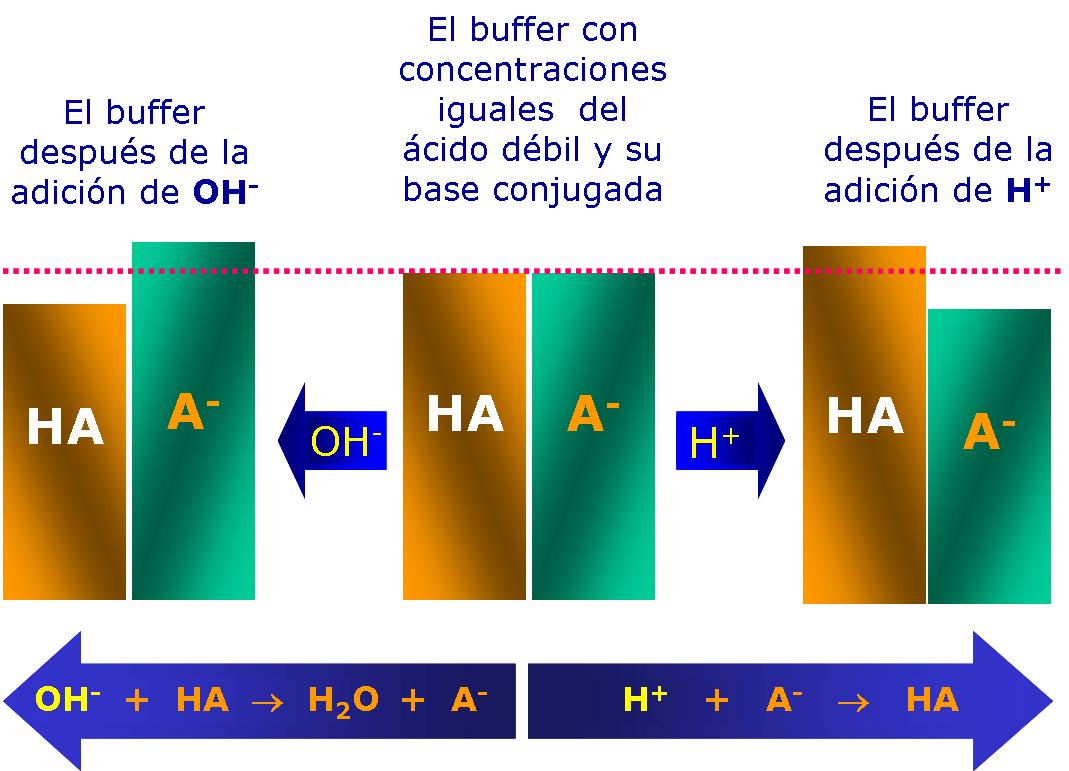
Un amortiguador (también llamado buffer o solución tampón) es una sustancia o combinación de sustancias que resiste los cambios del pH cuando se agrega un ácido o una base. Un sistema amortiguador incluye un ácido o una base débiles, los cuales no se ionizan por completo. Esto es, en cualquier instante dado sólo una fracción de las moléculas está ionizada; la mayor parte se encuentran no disociadas.
Los organismos contiene muchos ácidos y bases débiles, de modo que mantienen una reserva esencial de capacidad amortiguadora y evitan los extremos de pH.
~ Un ácido y una base reaccionan formando sal...
Cuando se mezclan un ácido y una base, el H⁺ del ácido se une al OH⁻ de la base y se forma una molécula de agua. El resto del ácido (un anión) se combina con el resto de la base (un catión) y se forma una sal.
Una sal es un compuesto en que el átomo de hidrógeno de un ácido es sustituido por otro catión.
Una sal, un ácido o una base que se disuelven en agua se disocian en iones que pueden conducir la corriente eléctrica; tales sustancias se denominan electrólitos. Otros compuestos no forman iones al disolverse en agua; tampoco conducen la corriente eléctrica, y se denominan no electrólitos o sustancias no electrolíticas.